导语:CRISPR-Cas9和相关基因编辑工具的核心DNA切割蛋白最初来自细菌,但显然在感染细菌的病毒中进化出了新发现的Cas蛋白。
新的Cas蛋白存在于已知的最大的细菌感染病毒中,称为噬菌体,是迄今发现的最紧凑的可工作Cas变体,是当今主要功能Cas9的一半。
体积更小,更紧凑的Cas蛋白更易于携带到细胞中进行基因组编辑,因为它们可以装入小型运载工具中,其中包括最受欢迎的运载工具之一:一种称为腺相关病毒(AAV)的失活病毒。超紧凑型Cas蛋白还可以在AAV内留出空间以容纳其他货物。
作为迄今为止已知的最小的Cas蛋白之一,新发现的CasΦ(Cas-phi)在必须将它们传递到细胞中以操纵农作物基因或治愈人类疾病时,具有优于当前基因组编辑工具的优势。
加州大学伯克利分校和加州大学伯克利分校创新基因组学研究所的博士后研究员帕特里克·鲍什(Patrick Pausch)表示:“腺病毒是提供基因编辑器的完美特洛伊木马:您可以轻松地对病毒进行编程,使其几乎到达人体的任何部位。” (IGI)是加州大学伯克利分校/加州大学旧金山分校的联合研究小组,致力于发现和研究用于农业和人类疾病的基因编辑的新颖工具。“但是,您只能将非常小的Cas9装入这种病毒才能进行传播。” 与Cas9相比,如果您拥有其他真正紧凑的CRISPR-Cas系统,则为您提供了足够的空间容纳其他元素:与Cas蛋白融合的不同蛋白质,DNA修复模板或其他调节Cas蛋白并控制基因的因子编辑结果。
显然,这些“巨噬细胞”使用CasΦ蛋白-希腊字母Φ或phi,是噬菌体的简写-诱使细菌抵抗自身而不是自身的病毒。
“实际上让我对研究这种蛋白质特别感兴趣的是,所有已知的CRISPR-Cas系统最初都是在细菌和古细菌中发现的,可以抵御病毒,但这是唯一一种全新的CRISPR-Cas系统IGI的博士生Basem Al-Shayeb说道。“这使我们考虑了这种蛋白质可能有什么不同,随之而来的是我们在实验室中发现的许多有趣的特性。”
在这些特性中:CasΦ进化为精简的,在一种蛋白质中结合了多种功能,因此可以省去Cas9的一半蛋白质片段。它与细菌最初的Cas9酶一样具有选择性地靶向DNA的特定区域,并且同样有效,并且可以在细菌,动植物细胞中起作用,使其成为有前途的,广泛适用的基因编辑器。
IGI执行董事珍妮弗·杜德纳(Jennifer Doudna)说:“这项研究表明,这种病毒编码的CRISPR-Cas蛋白实际上非常擅长于此,但它却小得多,只有Cas9的一半大小。”和细胞生物学,化学以及霍华德·休斯医学研究所的研究员。“这很重要,因为与使用Cas9相比,将它传递到细胞中可能要容易得多。当我们考虑CRISPR在未来的应用方式时,这确实是当前该领域最重要的瓶颈之一:交付。我们认为,这种非常小的病毒编码的CRISPR-Cas系统可能是突破这一障碍的一种方式。”
Pausch和Al-Shayeb是描述CasΦ的论文的第一作者,该论文将于本周在《科学》杂志上发表。
巨噬细胞携带自己的Cas蛋白
CasΦ蛋白是去年由Al-Shayeb在加州大学伯克利分校地球与行星科学与环境科学,政策和管理学教授吉尔·班菲尔德(Jill Banfield)的实验室中首次发现的。含有CasΦ的巨噬细胞属于它们被称为Biggiephage的一组,并存在于多种环境中,从春季水池和水饱和的森林地面到牛粪泻湖。
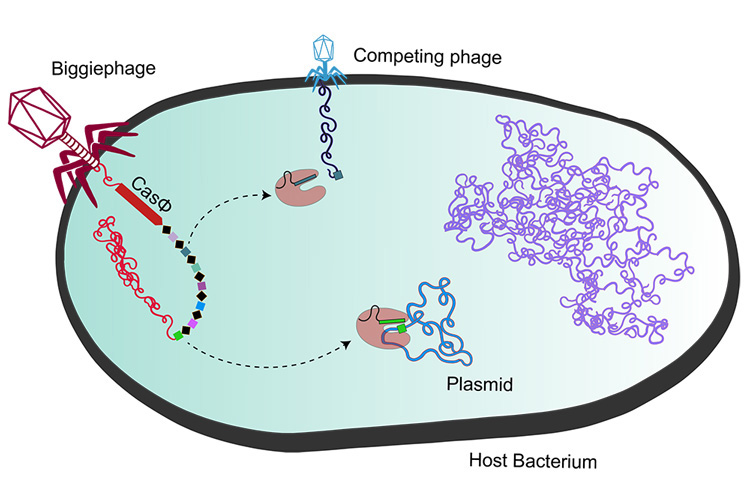
巨噬细胞(左)是噬菌体家族Biggiephage的成员,将其DNA(包括CasΦ(红色)的基因)注入细菌细胞,从而使细菌与噬菌体的竞争者对抗(上)。带有Pac-Man字样的红色数字是CasΦ蛋白,是一种切割病毒DNA的酶。细菌的基因组显示为紫色。(UC Berkeley图片由Basem Al-Shayeb和Patrick Pausch)
班菲尔德说:“我们使用宏基因组测序来发现许多不同环境中的细菌,古细菌和病毒,然后探索它们的基因清单,以了解生物体如何独立发挥作用并在其社区内结合发挥作用。” “噬菌体上的CRISPR-Cas系统是病毒与其宿主之间相互作用的一个特别有趣的方面。”
尽管宏基因组学使研究人员能够分离出编码CasΦ的基因,但是其序列告诉他们,它是V型家族的Cas蛋白,尽管在进化上与其他V型Cas蛋白(例如Cas12a,CasX(Cas12e)和Cas14)相距甚远。他们不知道它是否可以起到抵抗外来DNA的免疫系统的作用。目前的研究表明,与Cas9相似,CasΦ靶向并切割细菌细胞中的外源基因组,以及人类胚胎肾细胞和拟南芥植物细胞中的双链DNA。与Cas9相比,它还可以靶向更广泛的DNA序列。
CasΦ切割双链DNA的能力是一大优势。所有其他紧凑型Cas蛋白均优先切割单链DNA。因此,尽管它们可以很好地适合紧凑的递送系统(如AAV),但在编辑细胞内双链DNA时它们的用处就少得多。
Pausch说,就像在2012年首次认识到Cas9的基因编辑能力之后,对于为基因编辑优化CasΦ和发现设计针对特定基因的指导RNA的最佳规则,还有很多空间。
该论文的其他合著者是UC Berkeley的Ezra Bisom-Rapp,Connor Tsuchida,Brady Cress和Gavin Knott以及UCLA的Zheng Li和Steven E. Jacobsen。研究人员部分由Paul G.Allen Frontiers组,美国国立卫生研究院人体细胞基因组编辑协会(U01AI142817-02)和国家科学基金会(DGE 1752814)资助。
